Cosa è la Leucemia Mieloide cronica (LMC)
La LMC è una malattia mieloproliferativa, cioè una malattia neoplastica che colpisce le cellule staminali del midollo emopoietico da cui derivano i globuli bianchi (leucociti), le piastrine ed i globuli rossi. Alla base della malattia è un evento genetico che porta alla formazione del cromosoma Philadelphia (Ph), osservabile con le metodiche adeguate nelle cellule midollari in tutti pazienti e patognomonico della malattia.
Nella storia naturale della LMC si distinguono tre fasi successive:
-
fase cronica, durante la quale i leucociti vengono prodotti in eccesso per cui è caratterizzata da aumento dei leucociti nel sangue periferico associato a volte ad anemia e/o piastrinopenia oppure piastrinosi e spesso a splenomegalia
-
fase accelerata di transizione
-
fase blastica caratterizzata dalla perdita della capacità maturativa delle cellule leucemiche per cui il quadro clinico risulta simile a quello di una leucemia acuta.
La malattia viene generalmente diagnosticata in fase cronica, spesso in occasione di esami di routine quando il paziente è asintomatico. Molto raramente alla diagnosi il paziente si presenta in fase accelerata o blastica.
La malattia rappresenta circa il 15% di tutti i casi di leucemia e la prevalenza è stimata intorno a 1 caso su 100.000 persone/’anno. L’età media alla diagnosi è circa 60 anni e raramente inferiore a 20 anni. Non sono note le cause della malattia.
Attualmente l’andamento della malattia è stato profondamente modificato della terapia con gli inibitori delle tirosino-kinasi.
Basi biologiche della leucemia mieloide cronica
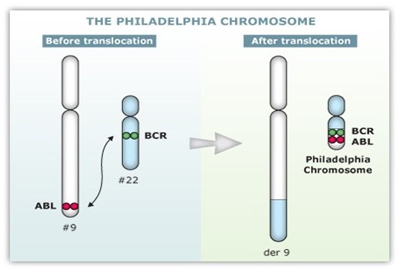
Il cromosoma Philadelphia (Ph; così chiamato dal nome della città in cui è stato scoperto nel 1960) rappresenta il marcatore caratteristico della LMC. Deriva dalla traslocazione acquisita reciproca tra un cromosoma 9 ed un cromosoma 22, t(9;22), e determina a livello molecolare la formazione di un gene di fusione tra il gene bcr (situato sul cromosoma 22) ed il gene abl (sul cromosoma 9). Il gene ibrido bcr-abl codifica per una proteina anomala che è alla base della patogenesi della malattia. Il gene abl sul cromosoma 9 appartiene alla categoria delle tirosino- chinasi (TK), enzimi che fosforilano i substrati a livello di residui di tirosina e si ritiene che abl sia in grado di attivare una “cascata” di altre attività enzimatiche intracellulari che innescano i meccanismi della proliferazione cellulare. Nella t(9;22) abl viene pressochè interamente traslocato sul cromosoma 22 e la proteina ibrida derivata dal gene ibrido bcr-abl mantiene una attività TK, aumentata e non più sottoposta a normali meccanismi di controllo. Da ciò deriva il potenziale leucemogeno della proteina ibrida, per le conseguenti interferenze a livello dell’attivtà proliferativa della cellula neoplastica, dei meccanismi di adesione e della responsività ai fattori regolanti la proliferazione, e dei meccanismi di morte cellulare (apoptosi).
La terapia della LMC
Sino a dieci anni fa, la terapia standard era rappresentata dall’Interferone (IFN). L’IFN consentiva la normalizzazione dell’emocromo nel 75% dei casi e nel 5-25% dei pazienti dopo 12-18 mesi di terapia si aveva la scomparsa del cromosoma Ph nel midollo (risposta citogenetica completa). Rispetto ai farmaci chemioterapici precedentemente impiegati (Oncocarbide, Busulfano) l’IFN ha effettivamente migliorato in modo significativo la sopravvivenza dei pazienti con LMC. Tuttavia IFN è gravato da molteplici effetti collaterali per cui in più del 30% dei casi si deve interrompere definitivamente la terapia. Una forma di terapia completamente diversa è rappresentata dal trapianto di cellule staminali emopoietiche da donatore geneticamente identico. Questa procedura, l’unica ritenuta in grado di eradicare la malattia, era ed è gravata da complicazioni severe, da una mortalità che dipende da vari fattori (primo fra tutti l’età del paziente) ed è praticabile solo in una percentuale modesta di pazienti che dispongono di un donatore idoneo (tra i familiari o dai Registri Internazionali di donatori di midollo).
A partire dal 2000 si è andata affermando una categoria innovativa di farmaci, specificamente rivolti verso la base biologica della malattia: gli inibitori delle tirosino-chinasi (TK). Dal momento che l’attività TK della proteina bcr-abl è essenziale alla patogenesi della LMC, sono state progettate e sperimentate una serie di molecole in grado di inibire l’attività chinasica di abl. Tra i prodotti in studio il più efficace, ed il primo ad essere impiegato nella pratica clinica, è risultato il composto noto come Imatinib mesilato o commercialmente in Italia Glivec®. I risultati degli studi in vitro ed i risultati dei primi studi clinici condotti su pazienti, permettono quindi di presentare Imatinib come uno dei primi e migliori esempi di “terapia molecolare” o terapia specificamente diretta contro l’evento molecolare causale di una neoplasia: nella LMC la cellula Ph positiva rappresenta il “bersaglio” o “target” contro cui è diretta la terapia con Imatinib (“targeted therapy”), con risparmio delle cellule normali Ph negative Oggi Imatinib è la terapia di prima scelta in pressoché tutti i pazienti diagnosticati affetti da LMC. Solo in un numero molto limitato di pazienti a bassissimo rischio trapiantologico, si può prendere in considerazione come prima linea di terapia il trapianto allogenico.

Imatinib nella terapia della LMC
Ampi studi multicentrici internazionali e nazionali hanno permesso di verificare l’efficacia di Imatinib nelle diverse fasi evolutive che caratterizzano il decorso della LMC: fase cronica, fase accelerata, fase blastica. Attualmente la dose standard di Imatinib è 400 mg/dì nei pazienti a fase cronica e 600-800 mg/dì in quelli in fase accelerata o blastica
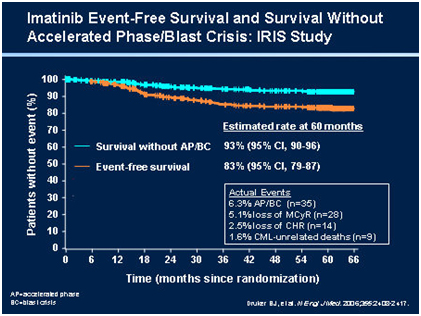
Fase cronica Uno studio internazionale (studio IRIS) iniziato otto anni fa ha dimostrato che Imatinib ottiene la risposta ematologia completa (normalizzazione dell’emocromo) nel 97% dei pazienti trattati e la risposta citogenetica completa (all’esame citogenetica del midollo: Ph= 0%) nell’84% dei casi. Complessivamente, a 8 anni dalla diagnosi il 90% dei pazienti è libero da progressione a fase accelerata o blastica. Questo studio ha inoltre dimostrato anche che la durata della sopravvivenza libera da progressione correla con la qualità della risposta citogenetica: i pazienti che dopo un anno di terapia con Imatinib sono in risposta citogenetica completa hanno un decorso più favorevole rispetto a quanti non hanno conseguito tale risposta. I risultati di questo studio fondamentale sono stati confermati in altri studi, condotti all’estero ed in Italia, presso le principali cliniche ematologiche.
Dal momento che Imatinib consente la risposta citogenetica completa in un’alta percentuale di pazienti, è diventato importante andare a studiare la malattia residua a livello ancora più profondo grazie alle indagini molecolari. Le metodiche di PCR quantitativa (PCR-Q) permettono infatti di “dosare” la quantità di trascritto anomalo bcr-abl presente nel sangue periferico e midollare. Con questa tecnica si è visto che i pazienti in risposta citogenetica completa possono essere ancora positivi per bcr-abl, pur presentando quantità di trascritto molto differenti. La qualità della risposta molecolare valutata su sangue periferico è importante per la prognosi: i pazienti citogeneticamente negativi che hanno ottenuto ad un anno una riduzione del trascritto bcr-abl >= a 3 logaritmi ( “risposta molecolare maggiore”, 40% dei casi a 12 mesi) sono liberi da progressione a fase avanzata, mentre i pazienti Ph negativi, ma con risposta molecolare meno buona potrebbero avere una maggior tendenza alla progressione in fase accelerata/blastica . La percentuale di pazienti che ottengono la risposta molecolare maggiore tende comunque ad aumentare con il proseguimento della terapia e raggiunge il 70-80% ad 8 anni dall’inizio del trattamento.
E’ fondamentale quindi dal punto di vista prognostico che il paziente ottenga la risposta citogenetica completa e una risposta molecolare perlomeno “maggiore”. Il fine della terapia sarà la negativizzazione molecolare, per quanto anche questa situazione non significhi probabilmente eradicazione della malattia e appaia relativamente rara.
Le informazioni sinora ottenute dagli studi clinici hanno portato alla formulazione di uno schema di monitoraggio che deve essere seguito per la corretta gestione del paziente:
| Emocromo e visita | Analisi citogenetica su mieloaspirato | Analisi molecolare quantitativa su periferico (PCR) |
|
ogni due settimane sino alla risposta ematologia completa ↓ |
a 3, 6, 12, 18 mesi sino alla risposta citogenetica completa ↓ |
ogni 3 mesi sino negatività molecolare” ↓
|
|
Ogni tre mesi
|
Una volta all’anno
|
Ogni 6 mesi
|
La risposta ematologia, citogenetica e molecolare ottenuta deve essere confrontata con le indicazioni proposte da European Leukemia-Net (aggioramento Journal of Clinical Oncology,2009) che definiscono la risposta ottimale, la risposta subottimale e il fallimento a diversi tempi della terapia.
Nonostante gli ottimi e duraturi risultati ottenuti con Imatinib, è innegabile che il problema della resistenza al farmaco esiste (complessivamente 15-20% dei pazienti). In fase cronica la resistenza primaria cioè il mancato raggiungimento degli obiettivi della terapia ai tempi stabiliti, è molto rara. Si ritiene che meccanismi indipendenti da bcr-abl ne siano più spesso responsabili e che quindi in questi casi il proseguimento di Imatinib alla dose standard non abbia significato e si debba considerare un cambiamento della terapia.
La resistenza secondaria cioè la perdita della risposta precedentemente ottenuta può essere dovuta a diverse cause: scarsa aderenza alla terapia da parte del paziente, interferenza metabolica da parte di farmaci assunti per patologie associate, riduzione della concentrazione intracellulare di farmaco, amplificazione del gene bcr-abl con conseguente iper-espressione dell’oncoproteina, comparsa di alterazioni genetiche aggiuntive. Una causa importante (50% dei casi) sembra essere rappresentata dalle mutazioni di abl nel contesto del gene ibrido bcr-abl. Queste mutazioni impediscono il legame e quindi l’attività di Imatinib; alcune condizionano solo una ridotta sensibilità a Imatinib, altre (come le mutazioni cosiddette P-loop o la mutazione T315I) causano una perdita completa della sensibilità al farmaco.
In caso di resistenza è’ innanzi tutto importante cercare di identificare la causa attraverso l’analisi citogenetica e la ricerca delle mutazioni di abl, tenendo presente che attualmente nella pratica clinica la causa della resistenza non è identificabile nel 40% circa dei casi.
Il trattamento della resistenza dipende dal tipo di resistenza riscontrato, dalle mutazioni di abl documentate, dalle caratteristiche del paziente. In alcune situazioni si può provare ad aumentare il dosaggio di Imatinib, mentre in altre è necessario cambiare farmaco e impiegare i “nuovi inibitori delle tirosin chinasi”. Questi sono Dasatinib e Nilotinib, attualmente in commercio con indicazione al trattamento della LMC resistente/intollerante a Imatinib. Entrambi i farmaci hanno mostrato efficacia nei pazienti resistenti a Imatinib: consentono di ottenere la risposta citogenetica maggiore (positività del cromosoma Ph nel midollo tra 0 e 35%) nel 40-50% dei casi e questa risposta citogenetica si sta dimostrando stabile a 2 anni di osservazione. I nuovi inibitori sono attivi verso la maggior parte delle mutazioni di abl, esclusa la mutazione T315I, che determina resistenza completa a Imatinib, Dasatinib e Nilotinib. L’emergenza di resistenza agli inibitori delle tirosino-chinasi deve far considerare l’ipotesi di trapianto allogenico.
Per quanto la terapia con Imatinib sia ben tollerata, non è del tutto priva di effetti collaterali. Può trattarsi di tossicità ematologia (eccessiva diminuzione dei leucociti, della Hb o delle piastrine) o di tossicità extraematologica, come per esempio ritenzione idrica (edema, specie orbitario), disturbi intestinali (nausea, vomito, dolori addominali, diarrea), crampi muscolari, dolori ossei ed articolari, eritema cutaneo, cefalea ed alterazione funzionale del fegato. Gli effetti collaterali sono generalmente di moderata entità e controllabili con le usuali terapie del caso a seconda delle necessità (diuretici, antidiarroici, antinausea, antiinfiammatori non steroidei, antistaminici). Possono essere contrastati attraverso momentanee interruzioni o con aggiustamenti di dose e solo raramente il paziente viene dichiarato intollerante ad Imatinib per cui si deve sospendere definitivamente il farmaco. In questo caso possono essere utilizzati i nuovi inibitori, in quanto è molto rara la intolleranza crociata con Imatinib.
Nel paziente anziano, che può avere patologie associate e quindi assumere altri farmaci, la terapia appare ugualmente efficace, ma forse è un po’ meno tollerata e negli ultrottantenni può essere indicato l’impiego di dosi più basse (300mg/die) ed una maggior attenzione agli effetti collaterali, soprattutto la ritenzione idrica.
Da segnalare infine i possibili problemi a carico della sfera genito-sessuale. Nel maschio Imatinib può (raramente) provocare ginecomastia. Più frequente la riduzione della conta degli spermatozoi nel liquido seminale (oligospermia). Se un paziente maschio in terapia con Imatinib decidesse di generare un figlio, sarebbe consigliabile sospendere per alcune settimane la terapia. Il problema è più complesso nella donna: Imatinib è considerato teratogeno ed è quindi sconsigliato il concepimento mentre si assume Imatinib. Nel caso una paziente rimanesse incinta in corso di terapia con Imatinib o desiderasse iniziare una gravidanza, si possono considerare diverse possibilità di intervento, ma non è possibile fare generalizzazioni e la situazione deve essere discussa individualmente.
La terapia con Imatinib, per quanto sappiamo oggi, non può essere interrotta definitivamente, ma deve essere condotta per tutta la vita anche se non sono ancora completamente noti gli effetti legati alla prolungata esposizione ad Imatinib. In alcuni rari pazienti in risposta citogenetica completa e molecolare completa stabili da anni si è provato ad interrompere la terapia: in alcuni di essi il monitoraggio rimane negativo, in altri si è verificata ricaduta molecolare o citogenetica, comunque di nuovo sensibile alla terapia.
Fase accelerata e blastica Nei pazienti in fase accelerata Imatinib alla dose di 600-800 mg/die consente un buon controllo ematologico che può essere mantenuto nel tempo. Le percentuali di risposta citogenetica sono superiori a quelle ottenibili con la chemioterapia convenzionale (cellule Ph+ midollari tra 0 e 35% nel 25-30% dei casi). In fase accelerata, i nuovi inibitori Nilotinib e Dasatinib risultano efficaci in una buona percentuale di pazienti che hanno sviluppato resistenza ad Imatinib. In fase blastica i risultati del trattamento con Imatinib sono meno brillanti: una risposta ematologica si osserva nel 50-55% dei casi, ma solo in alcuni pazienti è completa. Il trapianto allogenico (se fattibile) rappresenta in questi casi l’unica terapia di significato.
Quindi nelle fasi più avanzate di malattia la resistenza a Imatinib, dopo una iniziale risposta, rappresenta un fenomeno molto più frequente e rilevante rispetto alla fase cronica. Tuttavia, data la buona tollerabilità Imatinib può essere impiegato come trattamento “palliativo” nei pazienti in fase blastica che non sono candidati a terapie più aggressive (allotrapianto di midollo) ed è senz’altro utile il suo inserimento in protocolli chemioterapici in associazione ai citostatici.
Come migliorare i risultati di Imatinib?
Considerati gli ottimi risultati ottenuti con Imatinib in termini di risposta ematologia e citogenetica, si devono ricercare strategie per migliorare la risposta a livello molecolare, per prevenire l’insorgenza di resistenza e se possibile per eradicare le cellule staminali Ph positive che appaiono intrinsecamente meno sensibili ad Imatinib. Sono in corso studi che intendono valutare diversi approcci a questo scopo:
-
l’aumento del dosaggio giornaliero di Imatinib a 600-800 mg
-
l’impiego in associazione con altri farmaci a differente meccanismo d’azione (Interferone in particolare)
-
l’impiego in prima linea dei cosiddetti Inibitori di seconda generazione (Nilotinib e Dasatinib)
-
l’impiego in concomitanza o a rotazione di diversi inibitori delle tirosino-chinasi.
Redatto per i pazienti dalla dottoressa
Ester Orlandi
Divisione di Ematologia
Clinica Ematologica
Fondazione IRCCS Policlinico San Matteo
27100 Pavia
Italy





У вас можно статьи копировать ?
–
It is possible to copy articles from you?
Il semble que vous soyez un expert dans ce domaine, vos remarques sont tres interessantes, merci.
– Daniel
What a great resource!